
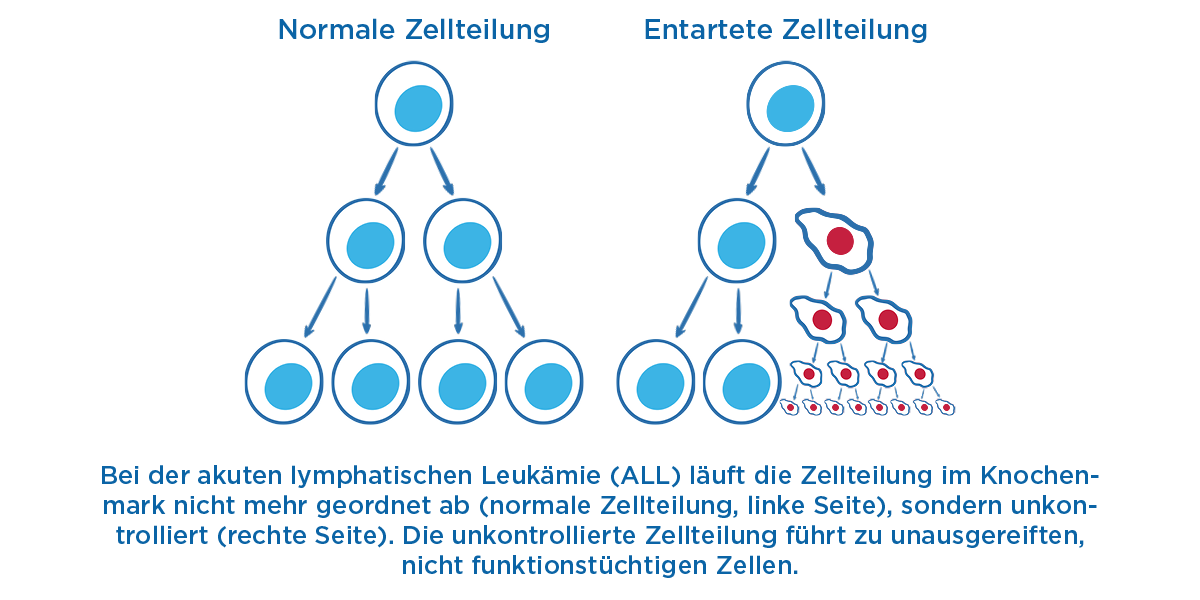
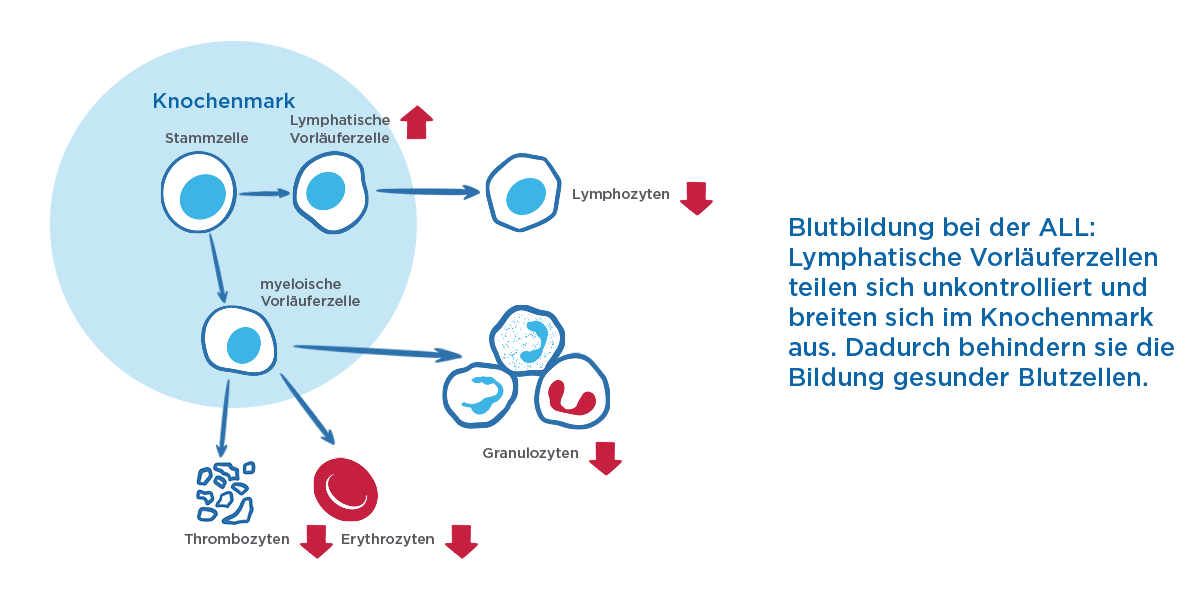
Es gibt verschiedene Formen von Leukämien. Bei der akuten lymphatischen Leukämie (ALL) vermehren sich die Vorläuferzellen (Zellen mit einer Vorprägung, jedoch dem Potenzial sich zu verschiedenen Zelltypen weiterzuentwickeln) der Lymphozyten (lymphatische Blasten) rasch und unkontrolliert, reifen aber nicht mehr zu funktionstüchtigen Zellen aus. Die zahlreichen unausgereiften lymphatischen Blasten beeinträchtigen im Knochenmark die normale Blutbildung, sodass nicht mehr ausreichend gesunde rote und weiße Blutkörperchen und Blutplättchen gebildet werden können.1,2 Nach der Ausbreitung im Knochenmark können sich die Blasten im Körper verteilen und andere Organe befallen und schädigen.1
Je nach Vorläuferzelle unterscheidet man verschiedene Formen der ALL. Entsteht eine ALL aus entarteten B-Zellen, wird diese als B-Zell-ALL bezeichnet. Ist eine T-Zelle der Vorläufer, spricht man entsprechend von T-Zell-ALL. B-Zell-ALL tritt hierbei häufiger auf und macht 75 % der Fälle aus, gegenüber 25 % für T-Zell-ALL. Je nach Reifegrad der Vorläuferzelle lassen sich weitere Unterformen der B-Zell-ALL und T-Zell-ALL definieren, darunter zum Beispiel die pro-B-Zell-ALL oder die common B-Zell-ALL, bzw. die pro-T-Zell-ALL oder die kortikale T-Zell-ALL. Diese Klassifizierung hilft bei der Auswahl einer geeigneten Therapie für die jeweilige Form der ALL.1
Die ALL ist eine seltene, aber schwere Erkrankung. Die Beschwerden entwickeln sich meist rasch innerhalb von Tagen bis Wochen. Unbehandelt würde die Erkrankung tödlich enden. Doch es gibt wirksame Therapiemöglichkeiten und es ist daher wichtig, nach der Diagnosestellung rasch mit der Behandlung zu beginnen.3
Akute lymphatische Leukämien treten sowohl im Kindes- als auch im Erwachsenenalter auf.4 Die vorliegenden Ausführungen beziehen sich ausschließlich auf die ALL bei Erwachsenen.

Die ALL ist eine seltene bösartige Erkrankung mit etwa 1,1 Neuerkrankungen pro 100.000 Einwohner jährlich. Besonders häufig erkranken Kinder unter 5 Jahren mit über 5 Neuerkrankungen pro 100.000 Kindern.4 Einen zweiten Häufigkeitsgipfel erreicht die Erkrankung bei über 50-Jährigen. Männer sind etwas häufiger betroffen als Frauen.4
Warum Patienten an ALL erkranken, bleibt in den meisten Fällen unbekannt.4 Wie bei anderen Krebserkrankungen spielen auch bei der Entwicklung der ALL Veränderungen des Erbmaterials (Genmutationen) eine Rolle, die bisher aber noch nicht vollständig erforscht sind (lesen Sie hier mehr zur Entstehung von Lymphomen und Leukämien). Experten gehen davon aus, dass eine Leukämie nur dann entsteht, wenn in einer einzigen Zelle mehrere Genveränderungen zusammenkommen. Faktoren wie radioaktive Strahlung und bestimmte giftige Substanzen können genetische Veränderungen begünstigen.1 Je höher die Strahlendosis, der ein Mensch ausgesetzt war, desto mehr steigt das Erkrankungsrisiko an.5 Zudem ist bekannt, dass Menschen mit Trisomie 21 ein erhöhtes Risiko für akute Leukämien haben.4
Wie andere bösartige Krebserkrankungen ist auch die ALL nicht ansteckend und kann nicht auf andere Menschen übertragen werden.1
Die Krankheitszeichen bei ALL ergeben sich einerseits durch die zu geringe Anzahl an gesunden Blutzellen und andererseits durch den Befall von Organen mit unreifen Leukämiezellen.1
Symptome der gestörten Blutbildung sind:1,4

Symptome, die durch Organbefall bedingt sind:1

ALL-Blasten können auch das Gehirn, das Rückenmark oder die Hirnhaut befallen. Dann kann es zu Kopfschmerzen, Lähmungen oder Sensibilitätsstörungen kommen.1 Eher selten ist ein Befall anderer Organe wie Brust, Hoden oder Haut zu beobachten.1
Zum Zeitpunkt der Diagnosestellung leidet ein Drittel der Betroffenen unter Blutungen oder Infektionen. Fast 60 % haben Lymphknotenschwellungen, ebenso häufig wird eine vergrößerte Milz beobachtet.4 In der Regel entwickeln sich die Symptome innerhalb von Tagen und es kommt rasch zu einem „Leistungsknick“.4
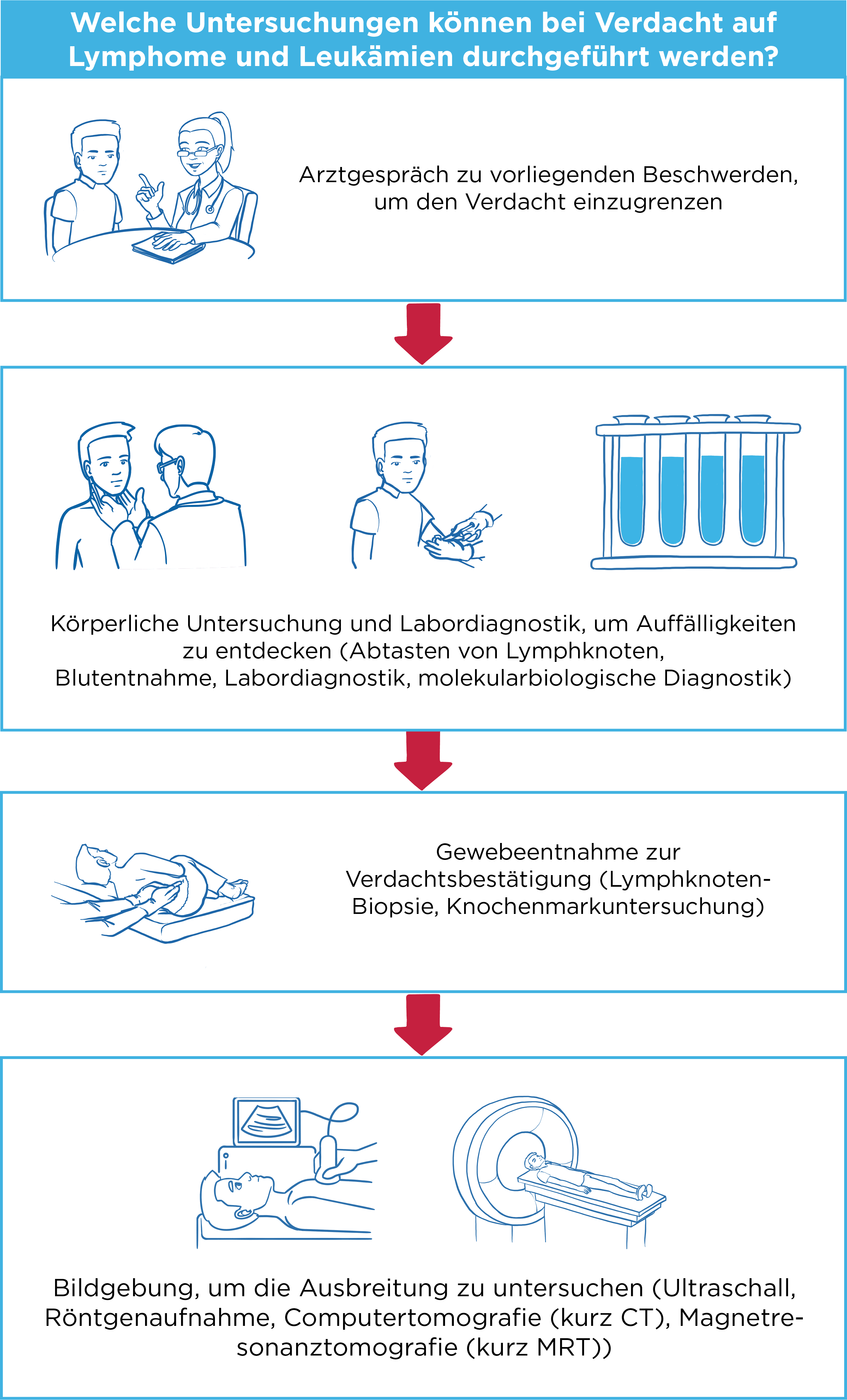
Besteht aufgrund der Beschwerden des Patienten und aufgrund der körperlichen Untersuchung der Verdacht auf ALL, veranlasst der Hausarzt verschiedene Blutuntersuchungen. Von besonderem Interesse sind dabei die Anzahl der verschiedenen weißen Blutkörperchen (Leukozyten) und die Frage, ob auffällige Zellen im Blut vorliegen. Falls sich der ALL-Verdacht erhärtet, wird der Patient zur genaueren Diagnostik an einen spezialisierten Hämatoonkologen überwiesen.1
Dort führen die Ärzte unter örtlicher Betäubung eine Knochenmarkpunktion durch, um Zellen für weitere Untersuchungen zu gewinnen. Das entnommene Material wird unter dem Mikroskop beurteilt. In weiteren speziellen Untersuchungen wird geklärt, ob die Leukämiezellen Veränderungen ihres Erbmaterials aufweisen: In der Zytogenetik werden Veränderungen der Chromosomen mikroskopisch untersucht, mit molekulargenetischen Methoden lassen sich mikroskopisch nicht erkennbare Veränderungen der Gene erfassen.1
Je nach Situation sind weitere Untersuchungen wie Röntgen, Sonografie der Bauchorgane oder Computertomografie erforderlich.4 So können sich die Ärzte einen Überblick über den Zustand und die Funktion der Organe verschaffen und die Therapie entsprechend planen.
Es gibt verschiedene Unterarten der ALL. Die Einteilung (Klassifikation) der ALL ist wichtig für die Wahl der passenden Behandlung, denn die Leukämiezellen der verschiedenen ALL-Untergruppen sprechen z. B. auf die Chemotherapie unterschiedlich gut an.1
Ein wichtiges ALL-Klassifikationssystem ist dasjenige der European Group for Immunologic Classification of Leukemias (EGIL). Es basiert vor allem auf immunologischen Untersuchungen. Dabei werden verschiedene Merkmale auf der Zelloberfläche der Lymphoblasten untersucht, die typisch für die einzelnen Entwicklungsstufen von B- und T-Zellen sind. Tabelle 1 stellt die ALL-Klassifikation der EGIL sowie die Häufigkeit der verschiedenen ALL-Untergruppen dar. In diesem System werden zwei Hauptgruppen der ALL unterschieden: B-Zell-ALL und T-Zell-ALL. Innerhalb dieser Hauptgruppen gibt es weitere Untergruppen. Die verschiedenen Unterformen können unterschiedlich verlaufen und auch mit unterschiedlichen Heilungschancen einhergehen.1

Immunologische Klassifikation der ALL (EGIL-Kriterien).1
In manchen Fällen treten bei der ALL genetische Veränderungen auf, die einen Einfluss auf die Behandlung und den Verlauf der Erkrankung haben. Diese Veränderungen betreffen häufig die Struktur der Chromosomen, wobei bestimmte Abschnitte zwischen zwei Chromosomen ausgetauscht werden. Dies bezeichnet man als Translokation und kann zu einer krankhaften Veränderung der Zelle führen. Die häufigste Chromosomenveränderung ist das sogenannte Philadelphia-Chromosom, das bei etwa einem Viertel der ALL-Patienten vorliegt. Hier kommt es zu einer Translokation zwischen Chromosom 9 und Chromosom 22. In der Folge wird ein abnormales Protein gebildet, das die Entstehung einer ALL begünstigt.1
Die Heilungschancen bei ALL hängen von verschiedenen Risikofaktoren ab. Anhand dieser Risikofaktoren können die Ärzte die Prognose (den voraussichtlichen Krankheitsverlauf) des Patienten abschätzen. Die Entscheidung, welche Therapie im Einzelfall am besten geeignet ist, wird auf der Basis dieser Risikofaktoren getroffen. Sie helfen u. a. bei der Abschätzung, ob eine Stammzelltransplantation durchgeführt werden sollte oder wie lange die Erhaltungstherapie durchgeführt werden muss. Folgende Kriterien sind dabei von Bedeutung:1
Sind die Risikofaktoren erfasst, können Patienten einer bestimmten Risikogruppe zugeordnet werden, damit sie die Behandlung erhalten, die die besten Heilungschancen für ihren individuellen Fall bietet. Patienten mit einem ungünstigen Risikoprofil erhalten dann in der Regel eine intensivere Therapie, um das Risiko eines Rückfalls (Rezidivs) zu senken.
Doch trotz Risikoabschätzung und sorgfältiger Therapieplanung kann niemand mit Sicherheit vorhersagen, wie der Krankheitsverlauf im Einzelfall sein wird und ob jemals ein Krankheitsrückfall auftreten wird.1
Mit molekulargenetischen Methoden ist es möglich, den Verlauf der ALL zu beurteilen. Das Prinzip beruht darauf, dass die Leukämiezellen jedes einzelnen Patienten ein spezielles, einzigartiges Muster an Eigenschaften aufweisen. Oft können einige charakteristische Merkmale nachgewiesen werden. Dies erlaubt es, Leukämiezellen auch dann noch genau zu identifizieren, wenn sie nach Behandlungsbeginn unter dem Mikroskop nicht mehr nachweisbar sind.
Durch die Bestimmung dieser sogenannten minimalen Resterkrankung (minimal residual disease, MRD) können Spezialisten feststellen, ob die Leukämiezellen komplett vernichtet wurden. In der mikroskopischen Untersuchung des Knochenmarks lässt sich ein Anteil von Leukämiezellen unter 5 % nicht mehr nachweisen; jedoch gelingt es mithilfe der Messung der MRD eine einzige Leukämiezelle unter 10.000 gesunden Zellen zu identifizieren (0,01 %).1
Um die MRD bestimmen zu können, muss zum Zeitpunkt der Diagnosestellung eine Knochenmarkprobe des Patienten an ein Speziallabor geschickt werden.1
Mithilfe der MRD-Bestimmung kann das Ansprechen auf die Therapie beurteilt werden. Außerdem gilt die MRD als wichtiger Prognosefaktor: Lässt sich keine MRD mehr nachweisen (negativer MRD-Status), spricht dies für einen günstigen Krankheitsverlauf.4

Wenn der Verdacht auf ALL besteht, sollen die betroffenen Patienten rasch an ein hämatologisches Zentrum mit entsprechender Erfahrung überwiesen werden, da die Erkrankung selten ist, rasch fortschreitet und die Therapie komplex ist.4 Unbehandelt würde die Erkrankung zum Tod führen; daher müssen die Ärzte umgehend eine Therapie einleiten, wenn sich die Verdachtsdiagnose „ALL“ bestätigt hat. Bei den meisten ALL-Patienten ist das Behandlungsziel die Heilung.3
Im Zentrum der ALL-Behandlung steht eine intensive Chemotherapie; in manchen Situationen kann auch eine Stammzelltransplantation Teil des Behandlungskonzepts sein. Eine „Standardtherapie“ der ALL gibt es nicht, welche Behandlung zum Einsatz kommt, hängt stark von der individuellen Situation des Patienten ab. Ärzte sollten ihre Patienten bevorzugt im Rahmen von Studien bzw. nach den Empfehlungen der Experten der deutschen ALL-Studiengruppe (GMALL = German Multicenter Study Group on Adult Acute Lymphoblastic Leukemia) behandeln. Die GMALL führt seit 1980 ein Studienprogramm zur Verbesserung der Therapie bei ALL durch.3

Die ALL-Therapie verläuft in verschiedenen Phasen: Vorphasentherapie, Induktionstherapie, Konsolidierungstherapie und Erhaltungstherapie. Darüber hinaus ist eine gezielte Behandlung des Gehirns erforderlich, da Leukämiezellen schon früh im Krankheitsverlauf das zentrale Nervensystem befallen können.3,4
Im Behandlungsverlauf überwachen die Ärzte regelmäßig bestimmte Blutwerte; so können sie erkennen, wenn die Blutbildung oder bestimmte Organe in ihrer Funktion gestört sind. Mithilfe von Knochenmarkuntersuchungen überprüfen sie den Behandlungserfolg.3
Bei allen ALL-Patienten soll eine Vorphasentherapie die Zerstörung der Leukämiezellen möglichst schonend einleiten. Die Behandlung erstreckt sich im Allgemeinen über 5 Tage und verläuft sehr patientenindividuell, weshalb keine pauschalen Aussagen zur Art der Behandlung getroffen werden können.3,4
Sie zielt darauf ab, innerhalb kurzer Zeit die Mehrzahl an Leukämiezellen zu vernichten, um eine komplette Remission zu erreichen. Von einer kompletten Remission sprechen Mediziner, wenn der Anteil der Leukämiezellen im Knochenmark unter 5 % fällt und sich die normale Blutbildung wieder erholt hat. In der Induktionsphase erhält der Patient eine Chemotherapie, in der mehrere Medikamente kombiniert werden.1
Die Chemotherapie mit den heute üblichen Medikamentenkombinationen wirkt bei der ALL in der Regel sehr gut. Je nach Alter lässt sich bei 80 bis 95 % der ALL-Patienten eine komplette Remission erreichen.1 Welche Art oder welche Kombination von Chemotherapien eingesetzt werden, ist bei der Induktionstherapie sehr unterschiedlich und richtet sich nach dem Zustand des jeweiligen Patienten sowie der ALL-Form.4
Die Konsolidierungstherapie schließt sich an die Induktion an und soll noch im Körper verbliebene bösartige Blutzellen vernichten und einen Rückfall verhindern.3 In dieser Phase verabreichen Ärzte höhere Medikamentendosierungen und andere Medikamentenkombinationen, um die noch im Körper vorhandenen Leukämiezellen abzutöten und dadurch das Risiko für einen Krankheitsrückfall (Rezidiv) zu senken.1
Die Konsolidierungstherapie besteht aus mehreren Therapieblöcken, zwischen denen mehrwöchige Pausen liegen.1 Die Wahl einer geeigneten Konsolidierungstherapie erfolgt für jeden Patienten individuell und kann nicht verallgemeinert werden.4
Eine Erhaltungs-Chemotherapie bekommen Patienten, bei denen keine Stammzelltransplantation durchgeführt wurde.3 Dabei wird täglich eine Tablette eingenommen und einmal wöchentlich ein weiteres Medikament in die Vene gegeben. Experten empfehlen derzeit, die Erhaltungstherapie über zweieinhalb Jahre durchzuführen.4
Die Chemotherapie spielt bei ALL eine zentrale Rolle. Bei der Chemotherapie werden sogenannte Zytostatika verabreicht, die Zellen daran hindern, sich zu vermehren, oder die Zellen abtöten. Die Chemotherapie wirkt im ganzen Körper und besonders gut gegen Krebszellen. Doch sie kann auch gesunde Zellen beeinträchtigen, daher können die Nebenwirkungen einer intensiven Chemotherapie erheblich sein. Ärzte ergreifen deshalb Maßnahmen, um die unerwünschten Wirkungen der Chemotherapie zu mildern.3
Bei der ALL reicht ein einziges Medikament nicht aus, um alle Leukämiezellen zu vernichten. Daher kombinieren Ärzte verschiedene Wirkstoffe, um möglichst gute Therapieerfolge zu erzielen.3
Bei etwas mehr als einem Drittel der Patienten tragen die Leukämiezellen eine spezielle Struktur auf ihrer Oberfläche, das sogenannte CD20-Antigen. Diese Patienten können mit einem Anti-CD20-Antikörper behandelt werden.3
Patienten, die eine bestimmte genetische Veränderung in ihren Leukämiezellen aufweisen, können mit einem zielgerichteten Medikament (zusätzlich zur Chemotherapie) behandelt werden.3
In bestimmten Erkrankungssituationen kann eine Stammzelltransplantation Teil der ALL-Behandlung sein.3 Dies ist beispielsweise der Fall, wenn ALL-Patienten ein erhöhtes Risiko für einen Krankheitsrückfall (Rezidiv) haben, wenn die Chemotherapie nicht den gewünschten Erfolg gebracht hat oder wenn ein Rezidiv eingetreten ist. Ob eine Stammzelltransplantation durchgeführt werden kann, hängt u. a. vom Alter und Gesundheitszustand des Patienten ab.1
Meist handelt es sich um eine allogene Stammzelltransplantation, bei der die Spenderzellen von einem Familienmitglied oder einem Fremdspender kommen.4 Der Einsatz der Stammzelltransplantation wird fortlaufend neuesten Forschungsergebnissen angepasst.1
Leukämiezellen können bereits bei der Diagnosestellung überall im Körper vorliegen, auch im Gehirn und Rückenmark.3 Daher geben die Ärzte Chemotherapeutika direkt ins Nervenwasser (Liquor) des Patienten. Zusätzlich behandeln sie auch systemisch mit Chemotherapeutika und/oder veranlassen eine Strahlentherapie des gesamten Gehirns.4
Viele ALL-Patienten erreichen unter der intensiven Erstbehandlung eine komplette Remission (Rückgang der Erkrankung); bei einigen kommt es allerdings zu einem Rezidiv, also zu einem Rückfall der ALL.3 Grund dafür ist, dass nicht alle Leukämiezellen im Körper durch die Therapie abgetötet werden konnten.1
Die Wahrscheinlichkeit eines Rezidivs ist in den ersten beiden Jahren nach einer kompletten Remission am höchsten.4 Bei einigen Patienten spricht die ALL von vornherein nicht oder nur unzureichend auf die Behandlung an.3 Die Symptome eines Rezidivs können ähnlich sein wie bei der Erstdiagnose, manchmal berichten Patienten aber auch über ganz andere Beschwerden.1
Leider bedeutet ein Rückfall, dass auch zukünftig ein hohes Rezidivrisiko besteht.1
Nach einem ALL-Rezidiv gibt es keine „Standardtherapie“.3 Die Behandlung ist komplex, und da laufend neue Medikamente und Therapieoptionen hinzukommen, sollten Patienten mit einem ALL-Rückfall möglichst umgehend an ein Zentrum mit entsprechender Erfahrung überwiesen werden.4 Wichtig ist, dass die behandelnden Ärzte über aktuelle Therapiemöglichkeiten gut informiert sind und den Patienten über die mögliche Teilnahme an einer geeigneten Studie beraten können.1
Auch bei einem Rezidiv erfolgt eine umfassende Diagnostik. So können die Ärzte u. a. herausfinden, ob die Leukämiezellen bestimmte Eigenschaften aufweisen, die eine gezielte Behandlung ermöglichen.4
Hauptziel der Behandlung eines ALL-Rückfalls ist es, eine komplette Remission zu erreichen und anschließend möglichst eine Stammzelltransplantation durchzuführen.4
Die Wahl der geeigneten Rezidivtherapie hängt von verschiedenen Faktoren ab, beispielsweise von der Dauer der ersten Remission, vom Alter des Patienten, von der Verfügbarkeit eines Stammzellspenders, aber auch von bestimmten Eigenschaften der Leukämiezellen und davon, welche Gewebe und Organe von der ALL befallen sind.4
Tritt das Rezidiv eineinhalb Jahre oder später nach der Erstbehandlung auf, kann oft die anfangs angewandte Induktionstherapie erneut durchgeführt werden.3,4 Bei früheren Rückfällen kommen neue Therapien mit sogenannten Antikörpern in Betracht.3,4
Wenn Patienten mit einem Rezidiv eine komplette Remission erreicht haben, folgt als nächster Schritt meist eine Stammzelltransplantation mit Stammzellen eines geeigneten Spenders (allogene Transplantation). Dies setzt voraus, dass Alter und Allgemeinzustand des Patienten eine Transplantation erlauben und dass ein geeigneter Stammzellspender gefunden werden kann.3
Eine weitere Behandlungsoption bei erwachsenen Patienten mit ALL ist die CAR-T-Zelltherapie. Hierbei werden patienteneigene Immunzellen genetisch umprogrammiert, sodass diese die Krebszellen erkennen und bekämpfen.4 Diese individualisierte Behandlung kann bei Patienten eingesetzt werden, die einen Rückfall erleiden oder deren ALL nicht auf die bisher durchgeführte Therapie anspricht.
Im Anschluss an die ALL-Therapie sind regelmäßige Nachsorgeuntersuchungen erforderlich, die in der Regel ambulant durchgeführt werden.1
Regelmäßige Nachsorgetermine tragen dazu bei, einen möglichen Rückfall früh zu erfassen und eine geeignete Behandlung einzuleiten. Durch die Kontrolluntersuchungen sollen aber auch Spätfolgen der ALL-Behandlung erkannt werden. Welche Untersuchungen bei Verdacht auf Spätfolgen durchgeführt werden, richtet sich nach den Beschwerden des Patienten. Die meisten ALL-Patienten in Langzeitremission sind jedoch als geheilt anzusehen, und sie leiden meist auch unter keinen Spätkomplikationen.4
Um Anzeichen für einen Rückfall oder Spätfolgen der ALL-Therapie zu erfassen, befragt der Arzt den Patienten ausführlich zu seinem Befinden und führt eine körperliche Untersuchung durch.1 Hinzu kommen Kontrollen von Blut und Knochenmark. Je nach Befinden bzw. Beschwerden des Patienten können weitere Untersuchungen veranlasst werden.
Nach Abschluss der ALL-Therapie finden die Kontrolltermine zunächst engmaschig statt, danach werden die Intervalle zwischen den Nachsorgeuntersuchungen größer.1

Anamnese und körperliche Untersuchung: Der Arzt befragt den Patienten ausführlich zu seinem Befinden (neu aufgetretene Lymphknotenschwellungen oder Beschwerden, z. B. B-Symptome wie Fieber, Gewichtsverlust oder Nachtschweiß) und führt eine gründliche körperliche Untersuchung durch. Dabei tastet er die verschiedenen Lymphknotenstationen beispielsweise am Hals, in den Achseln und in der Leistengegend sowie den Bauch ab.3

Blutentnahme: Der Arzt untersucht die Zusammensetzung des Blutes und kann die Anzahl der verschiedenen im Blut vorhandenen Zellen sowie weitere Blutwerte bestimmen.3
Bitte beachten Sie, dass die auf dieser Website aufgelisteten Therapieoptionen ausschließlich Ihren Informationszwecken dienen und keinen Anspruch auf fachliche Vollständigkeit bieten.
Diese Informationen stellen daher keinen Ersatz für eine individuelle Beratungs- oder Behandlungsleistung, Empfehlung oder medizinische Diagnose durch einen Arzt dar und dienen keinesfalls der Selbstdiagnose.
Abkürzungen
ALL: akute lymphatische Leukämie
CAR: Chimeric Antigen Receptor
EGIL: European Group for the Immunological Characterization of Leukemias
GMALL: German Multicenter Study Group on Adult Acute Lymphoblastic Leukemia, deutsche ALL-Studiengruppe
MRD: Minimal Residual Disease, minimale Resterkrankung
Quellen