

Bei der allogenen Stammzelltransplantation stammen die gesunden Blutstammzellen von einem geeigneten Fremd- oder Familienspender.
Bei einer allogenen Stammzelltransplantation wird – wie bei einer autologen Stammzelltransplantation – das Prinzip angewendet, die Krebszellen zunächst durch eine Hochdosis-Chemotherapie zu zerstören und das blutbildende System danach mit gesunden Stammzellen neu zu starten. Ein großer Unterschied zur autologen Stammzelltransplantation: Es handelt sich bei Spender und Empfänger nicht um dieselbe Person. Eine allogene Stammzelltransplantation wird vorgenommen, wenn eine autologe Stammzelltransplantation nicht möglich ist.

Es muss daher ein geeigneter Spender gefunden werden, der in den wesentlichen Gewebemerkmalen mit denen des Empfängers übereinstimmt. Um einen solchen zu finden, werden deutschlandweit, auch weltweit, Knochenmarkspenderregister durchsucht.1
Nachdem die Zellen des Spenders übertragen wurden, bilden diese das Blut- und Immunsystem neu. Dabei greift das Immunsystem Krebszellen an, die potenziell die Hochdosis-Chemotherapie überlebt haben. Das Immunsystem erkennt also die Krebszellen als fremd. Diese Wirkung wird als „Graft-versus-Leukämie/Lymphom-Reaktion“ bezeichnet.1

Graft-versus-Leukämie/Lymphom-Reaktion
Die Graft-versus-Leukämie/Lymphom-Reaktion ist eine gewünschte Wirkung, die bei einer allogenen Stammzelltransplantation auftritt. Dabei greift das Immunsystem des Spenders die Krebszellen des Empfängers an.
Graft-versus-Host-Reaktion
Sie ist eine unerwünschte Nebenwirkung, die im Zuge einer allogenen Stammzelltransplantation auftreten kann. Dabei greift das fremde Immunsystem des Spenders die normalen körpereigenen Zellen des Empfängers an. Die Graf-versus-Host-Reaktion kann tödlich verlaufen.


Bei der allogenen Stammzelltransplantation kommen die Stammzellen wie bereits erwähnt von einem Familien- oder fremden Spender.
Dieser muss in den wesentlichen Gewebemerkmalen (HLA-Merkmalen) mit dem Patienten übereinstimmen. Diese Merkmale kommen auf der Oberfläche fast aller Körperzellen vor und helfen dem Immunsystem, eigenes von fremdem Gewebe zu unterscheiden.
Durch die größtmögliche Übereinstimmung wird das Risiko einer Abstoßung sowie einer Graft-versus-Host-Reaktion so gering wie möglich gehalten.
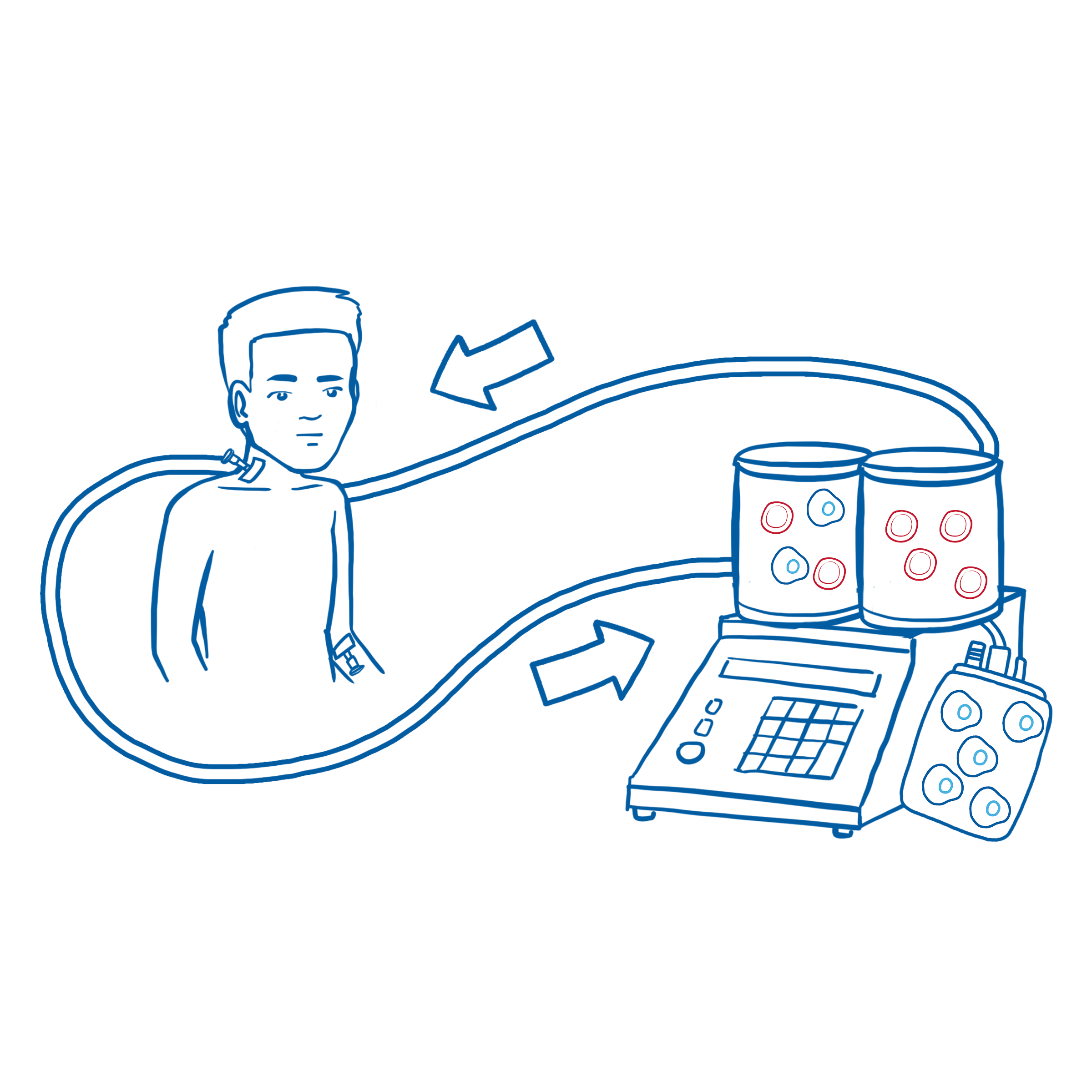
Von einem Familien- oder Fremdspender mit passenden Gewebemerkmalen werden Stammzellen gesammelt. Der Spender spritzt sich dazu zweimal täglich für vier bis fünf Tage bestimmte Medikamente, die die Anreicherung von Stammzellen anregen.
Bei einer sogenannten Apherese wird dem Spender Blut entnommen und die Stammzellen herausgefiltert. Die nicht für die Transplantation benötigten Blutzellen erhält der Spender per Infusion wieder zurück.
Alternativ kann man die Stammzellen durch eine Operation direkt aus dem Knochenmark gewinnen und dann genauso wie die Blutstammzellen transplantieren.

Vor dem geplanten Transplantationstermin erfolgt eine stationäre Aufnahme.
Wurde eine ausreichende Menge an Stammzellen gesammelt, erhält der Patient eine Chemotherapie, eventuell in Kombination mit einer Ganzkörperbestrahlung. Dadurch wird das Immunsystem und die Blutbildung weitgehend unterdrückt, um eine Transplantatabstoßung zu verhindern und im Idealfall auch die Krebszellen restlos aus dem Körper zu beseitigen. Zusätzlich dient die Konditionierung dazu, „Platz“ zu schaffen für die transplantierten Spenderstammzellen.
Zusätzlich müssen Medikamente eingenommen werden, die das Immunsystem unterdrücken (Immunsuppression). Das soll verhindern, dass sich die fremden Stammzellen des Spenders und das Immunsystem des Patienten gegenseitig bekämpfen.
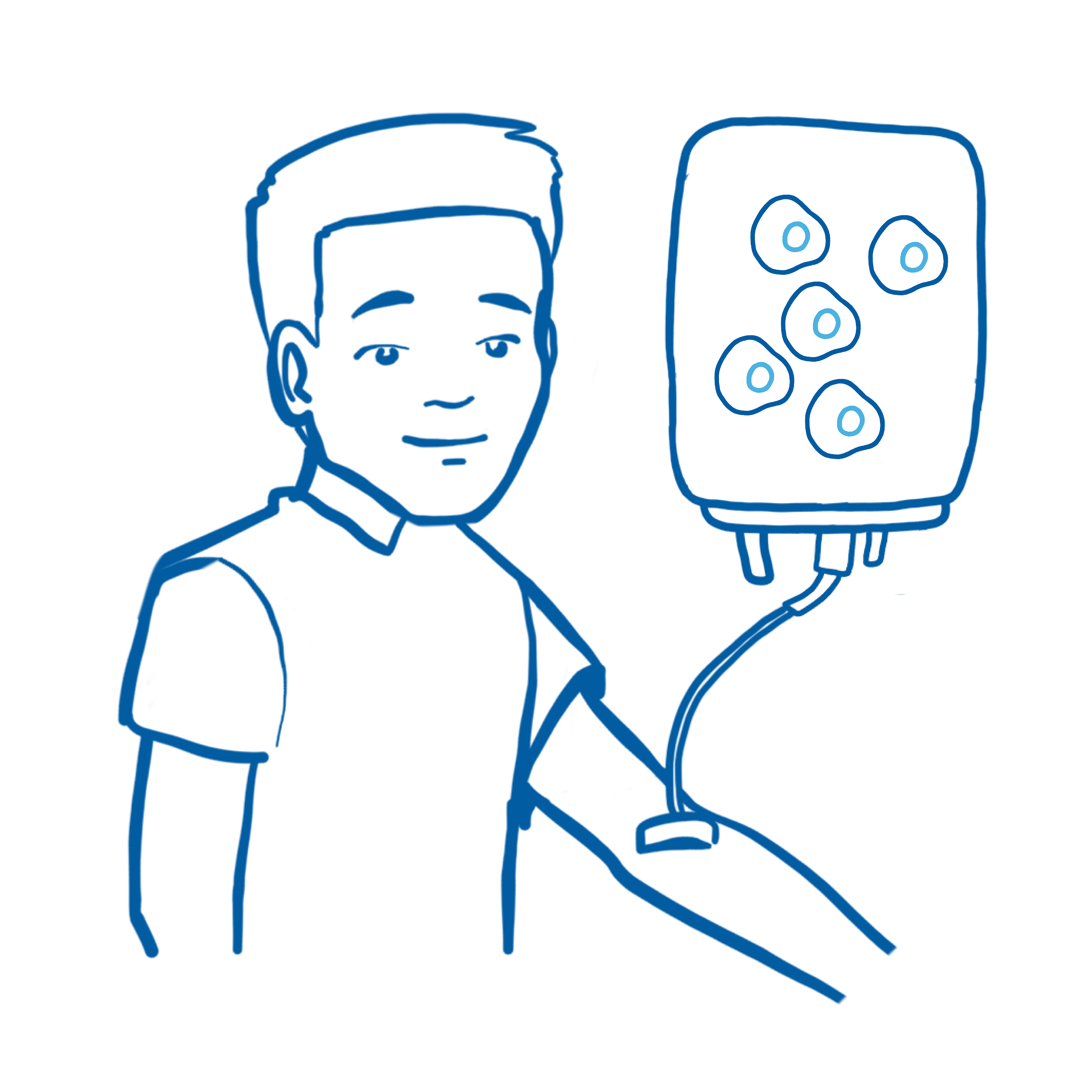
Nach der Konditionierung erhält der Patient die Stammzellen des Spenders mittels einer Infusion.
Das Ziel ist es, dass sich aus diesen Stammzellen wieder ein gesundes Blutsystem mit funktionsfähigen Immunzellen entwickeln kann.
Zusätzlich greift das sich neu bildende Immunsystem die Krebszellen an, die potenziell die Chemotherapie überlebt haben (Graft-versus-Leukämie/Lymphom-Reaktion).

Aufgrund von beträchtlichen Nebenwirkungen und Langzeitfolgen allogenen Stammzelltransplantation ist eine umfassende Langzeitnachsorge erforderlich. Eine enge Zusammenarbeit mit den behandelnden Ärzten ist deshalb sehr wichtig.

Im Folgenden werden mögliche Nebenwirkungen der allogenen Stammzelltransplantation beschrieben.
Bei einer allogenen Stammzelltransplantation besteht das Risiko, dass der Körper das fremde Immunsystem abstößt. Außerdem ist die Infektionsgefahr nach einer allogenen Stammzelltransplantation stark erhöht. Daher erfolgt die Behandlung oft in einem Einzelzimmer mit einer Isolierung, um eine mögliche Einschleppung von Krankheitserregern zu minimieren.
Eine weitere mögliche Nebenwirkung einer allogenen Stammzelltransplantation ist die sogenannte „Graft-versus-Host-Reaktion“, auf Deutsch „Transplantat-gegen-Wirt-Erkrankung“. Dabei greift das fremde Immunsystem die körpereigenen normalen Zellen an.1 Es werden zwei Arten unterschieden:2
Hierbei handelt es sich um eine Auswahl der wichtigsten/häufigsten Nebenwirkungen, prinzipiell können auch noch weitere auftreten.
Aufgrund der beträchtlichen Nebenwirkungen und Langzeitfolgen der allogenen Stammzelltransplantation ist eine umfassende Langzeitnachsorge erforderlich, die durch eine enge Kooperation zwischen Hausarzt, niedergelassenen Fachärzten, Patient und Transplantationszentrum gewährleistet wird.6
Bitte beachten Sie, dass die auf dieser Website aufgelisteten Therapieoptionen ausschließlich Ihren Informationszwecken dienen und keinen Anspruch auf fachliche Vollständigkeit bieten.
Diese Informationen stellen daher keinen Ersatz für eine individuelle Beratungs- oder Behandlungsleistung, Empfehlung oder medizinische Diagnose durch einen Arzt dar und dienen keinesfalls der Selbstdiagnose.
Abkürzungen
HLA: humanes Leukozyten-Antigen
Quellen